摘 要
香港中文大学秦岭教授团队最新综述: 随着人口老龄化的迅速加剧,骨科手术的数量预计将不断增加。由于法规对生物安全性和治疗有效性的要求,临床骨科应用的材料与研发中的材料之间存在明显差距。对于临床的需求,如何克服障碍实现有影响力的创新和骨科材料的临床转化?镁是一种新兴的生物活性物质,是人体的重要组成部分之一,主要作为基质成分或细胞内元素储存在肌肉骨骼系统中,维持各种生理功能的稳态。然而,镁的降解和生物力学性能限制了其应用。本文旨在探讨镁在临床转化中的当前挑战和未来方向,并提供骨科生物材料、骨科创新驱动因素、镁离子生理学及其潜在临床应用的最新进展。为实现骨科应用,本文描述了镁作为植入金属的性能优化和镁降解产物在体内的功能。
临床实践中,为治疗激素性骨坏死(SAON),创新性地提出镁螺钉和镁基复合多孔支架(Mg/PLGA/TCP:镁/聚乳酸-羟基乙酸(PLGA)/磷酸三钙(TCP)的治疗策略,但镁基植入物在承重部位仍然存在挑战。为了利用镁降解的良好生物效应,克服骨折固定机械稳定性的弱点,本文提出了镁/钛组合骨科植入物的概念,其中钛组件提供有效的机械支持,而镁组件可以优化钛组件的生物力学性能,同时促进骨愈合。本综述有望为新材料的转化提供参考,以期促进骨科生物创新材料的临床应用。
研究内容简介
一、生物材料的发展介绍
生物材料的发展历程可以分为多个阶段,从最初的生物惰性材料,到生物活性材料,再到可降解材料,以及当前的功能化与智能化生物材料,如图1。在骨科领域,生物材料主要用于医疗器械的组成部分和组织工程中的组织替代与再生。镁作为一种新兴的可降解生物活性材料,因其在人体中的自然存在和良好的生物相容性,受到广泛关注。镁具有多种生理功能,包括促进成骨、成血管、抗菌和抗炎等,但其快速降解和不足的机械性能限制了其在负重骨骼部位的应用。
为了克服这些挑战,研究人员正在探索多种策略,包括合金化、表面处理和组合植入物的设计。例如,镁/钛组合植入物结合了钛的机械强度和镁的生物活性,有望在骨折固定和骨愈合中发挥重要作用。此外,3D打印技术的应用为制造个性化的镁基植入物提供了可能,这些植入物可以根据患者的具体需求进行定制。多孔镁复合支架材料已被证明具有良好的生物安全性,可以促进骨髓间充质干细胞的增殖,并且在植入动物骨缺损后未引起明显的病理变化。随着临床需求的增加和新技术的成熟,镁作为一种新兴的生物活性材料,将在骨科应用中拥有更多样化和光明的前景。
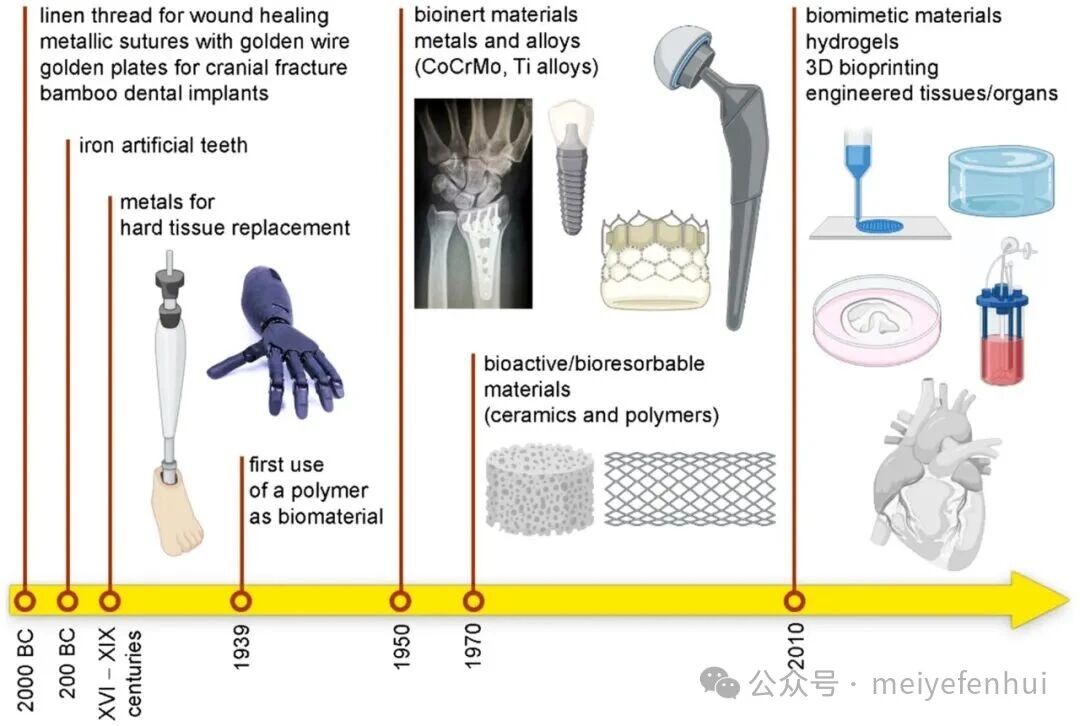
图1生物材料从生物惰性阶段到生物活性/生物可降解阶段再到功能化和智能化阶段的发展(版权所有©2021,Todros et al.)
二、骨科生物材料的应用现状与进展
1. 金属
金属和金属合金因其生物相容性、高强度和合理的耐腐蚀性而被广泛应用于骨科领域,作为承重部件,包括不锈钢、钴铬合金、钽、钛及其合金等。然而,其耐磨性较差限制了其在假体关节表面的应用,植入界面产生的磨损颗粒增加了离子毒性风险。此外,金属及其合金的高杨氏模量可能会导致周围骨的应力遮挡,从而引发骨吸收,进一步影响骨再生和骨科植入物的骨整合稳定性。镁及其合金作为新兴的可降解金属,由于其在降解过程中与宿主组织的相互作用,展现出巨大的骨科应用潜力。图2显示了作为骨科医疗器械的金属材料。
2. 陶瓷
陶瓷根据其与生物系统的相互作用被分为生物惰性和生物活性两类。以氧化铝(Al2O3)和氧化锆(ZrO2)为代表的生物惰性陶瓷具有优越的耐磨性和高韧性,使其适用于股骨头部件、衬垫、人工膝关节和牙科植入物。生物活性陶瓷可用于修复骨缺损、填充骨肿瘤切除后的空腔、椎体修复和融合或作为涂层以促进成骨。羟基磷灰石和钙磷灰石作为骨替代物和涂层被广泛接受,它们可以在生理液体中释放离子,随着植入时间的延长刺激成骨。生物活性玻璃,如生物玻璃45S5,被提出以区别于生物惰性材料,并扩展到硅酸盐玻璃、钙磷酸盐玻璃等。生物活性玻璃的性能随着成分的变化而变化,以促进成骨、血管生成、抗炎和抗菌,而挑战在于其低抗拉强度和韧性。为了增加玻璃的韧性,可通过控制玻璃的结晶合成玻璃陶瓷。
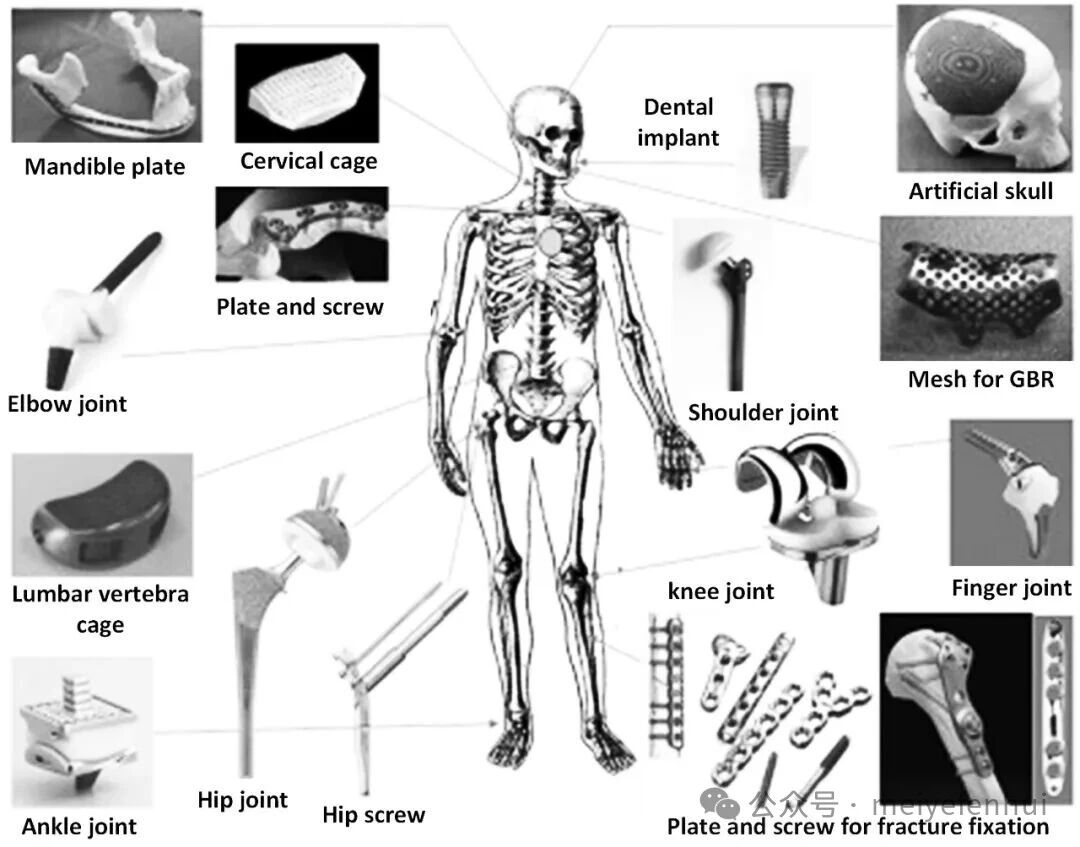
图2 用于医疗器械的骨科生物材料(经Elsevier©2019许可,转载)
3. 聚合物
聚合物因其高强度、韧性、耐磨性或与骨相近的杨氏模量而在骨科承部位得到广泛应用,包括碳纤维、超高分子量聚乙烯(UHMWPE)、聚醚醚酮(PEEK)和聚甲基丙烯酸甲酯(PMMA)等。碳纤维被用于骨科手术的内固定,但碳颗粒释放到周围介质中可能会导致系统性毒性以及软组织相关并发症。UHMWPE是一种分子量在200万到600万之间的聚乙烯聚合物,自1962年Charnley引入骨科以来,已用于全髋关节置换和全膝关节置换,标志着骨科手术的一个重要里程碑。PEEK因其类骨的模量以及减轻应力遮挡的能力而被用于颅骨修复、界面螺钉和椎间融合等。聚甲基丙烯酸甲酯(PMMA)被公认为一种用于植入物固定的骨水泥。PMMA的成分包括PMMA共聚物、作为放射不透明剂的氧化钡和作为聚合引发剂的过氧化苯甲酰。上述聚合物是生物惰性的,而可降解聚合物由天然可降解聚合物(如壳聚糖、透明质酸、明胶、胶原蛋白、丝素蛋白、海藻酸和纤维素)和合成可降解聚合物(如聚羟基酸、聚乳酸和共聚物)组成。水凝胶是一种高亲水性的大分子材料,可以制成具有成骨和成血管能力的支架,也可以与各种材料或药物复合以实现所需的治疗效果。由于镁基材料的快速降解率和碱性环境,结合聚合物以改善镁基材料的物理性能和生物相容性是一个有前途的研究和临床转化方向。
4. 功能复合材料
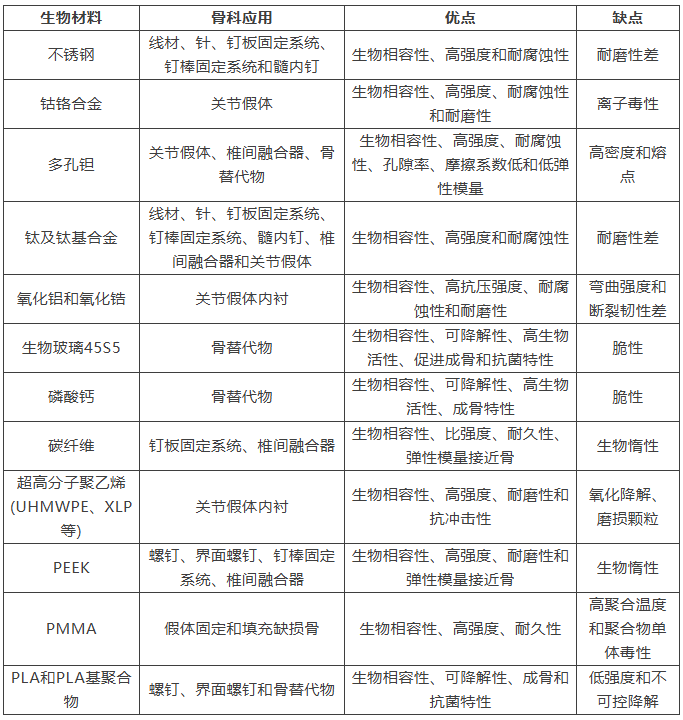
功能复合材料利用对外源性/内源性刺激的响应性来实现可控的治疗效果,包括抗菌、抗肿瘤、成骨和血管生成特性。单一或多种物理信号(包括光热、机械、声学、电和磁信号)被用来诱导功能复合材料的响应。基于光热效应,当黑磷(BP)标记的响应性锶(Sr)水凝胶颗粒暴露于近红外辐射时,微颗粒会经历体积收缩并释放封装的Sr离子,以实现抗炎、抗凋亡、细菌抑制和成骨刺激的治疗目标。机械响应的压电PLLA纳米纤维支架在机械应力或关节负荷条件下促进兔子模型中的软骨生成和再生。超声响应的PLLA/Au@铌酸钾支架与声动力疗法结合,用于解决植入物相关感染。磁响应水凝胶结合磁性氧化铁纳米颗粒,对交变磁场表现出响应性,具有深入组织穿透能力,能够在前成骨细胞内实现成骨分化、血管生成分化和生物矿化过程。尽管在功能复合材料领域取得了显著进展,但在实现成功临床应用之前仍面临相当大的挑战。常见的骨科生物材料及其优缺点见表1。
表1 常见的骨科生物材料及其优缺点
三、骨科植入物的创新驱动力
1. 技术驱动的创新
随着尖端技术的发展,3D打印、手术机器人、人工智能和机器学习已引入并应用于骨科。其中,3D打印以其个性化医疗和精准医疗的便利性,拓展了生物材料的应用范围。钛合金在骨科中得到了广泛应用,但其杨氏模量高于骨,导致植入物在承重骨骼部位出现下沉或松动。优化植入物结构以使钛合金的机械性能与周围骨组织相匹配是一种有效方法。此外,如果将具有负泊松比的多孔结构整合到植入物中,它不仅会提供多孔空间以促进骨长入,还会通过压缩刺激周围骨,避免由应力遮挡引起的骨吸收。镁的杨氏模量接近骨,降低了应力遮挡的风险。3D打印带来了制造特定植入物和实现镁可控降解的机会。类似于3D打印,生物制造能够通过组装生物材料和细胞成分,精确模仿宿主组织的结构和功能,形成生物工程支架。生物墨水包括纳米材料、细胞、药物和生长因子,这些可以赋予镁基支架满足特定生物医学目标所需的特性。支架越接近天然组织,就越能有效地修复损伤。这些方面包括生物力学特性(如机械强度和结构架构)、化学行为(如细胞因子表达的调节)以及细胞响应调节(包括细胞的募集和分化),这也可能是3D生物打印制造的镁基支架的主要研究范围。
2. 市场驱动的创新
为了减轻医疗系统的财政负担,中国实施了基于采购量的采购策略,通过大量采购降低产品价格,该策略占骨科植入物市场的80%以上。另一方面,国家药品监督管理局(NMPA)支持创新医疗器械的研发,以促进产品演变,从而提高治疗效果。创新医疗器械免于带量采购,从而使其能够占据更多市场份额并寻求额外的利润空间。镁作为一种新兴的生物活性材料,仍处于取代或部分取代临床上常规骨科植入物的初级阶段。然而,市场驱动的创新植入物并不总是优于前代产品。新一代膝关节假体旨在增加髌股关节的贴合度,与前代版本相比,后置的柄增加了后胫骨皮质撞击的风险,可能会引发随后的不适和假体周围骨折的发生率。对于市场驱动的创新骨科材料,需要进行批判性评估,以控制临床风险并增强治疗效果。
3. 临床需求驱动的创新
临床需求是植入物创新的重要来源,可以有效连接发现-发明-临床转化。生物设计模式(Biodesign Innovation Process)是一种备受赞誉的以需求为导向的创新方法,它起源于临床发现,并得到外科医生和临床医生的实际见解的支持。对于以临床需求为导向的创新,人工髋关节的应用以取代晚期骨关节炎是一项开创性的工作。根据力学匹配和形貌匹配的原则,采用由PMMA骨水泥实现柄与周围骨的固定。然而,不良的骨水泥技术、增加的柄偏移、减少的柄长度、粗糙的表面光洁度以及圆形截面的柄设计都被指出为导致骨水泥柄失败的因素。作为替代品的非骨水泥柄,通过与植入物的骨整合来提供初始稳定性。以临床需求为导向的创新促进了临床问题的解决,并优化了治疗策略,以实现更好的结果。镁作为辅助固定或填充替代物是最有希望的骨科应用领域,但满足临床需求的物理特性仍有待研究。因此,用于骨科应用的镁基生物材料应将临床问题作为最初的驱动力,并引入先进的工程技术与科学理论来解决这些问题,最终在临床上验证其有效性。
四、骨质疏松性骨折中基于骨病理生理学的钉板固定系统设计
1. 骨质疏松性骨折的生物学和病理生理学
骨质疏松症作为一种常见的全身性骨骼疾病,随着年龄的增长,其发病率增加,特征是骨量减少和骨微结构受损。复杂的生物学和病理生理学机制相互作用,阻碍了骨质疏松性骨折的正常愈合过程,并在临床管理中构成了重大挑战。
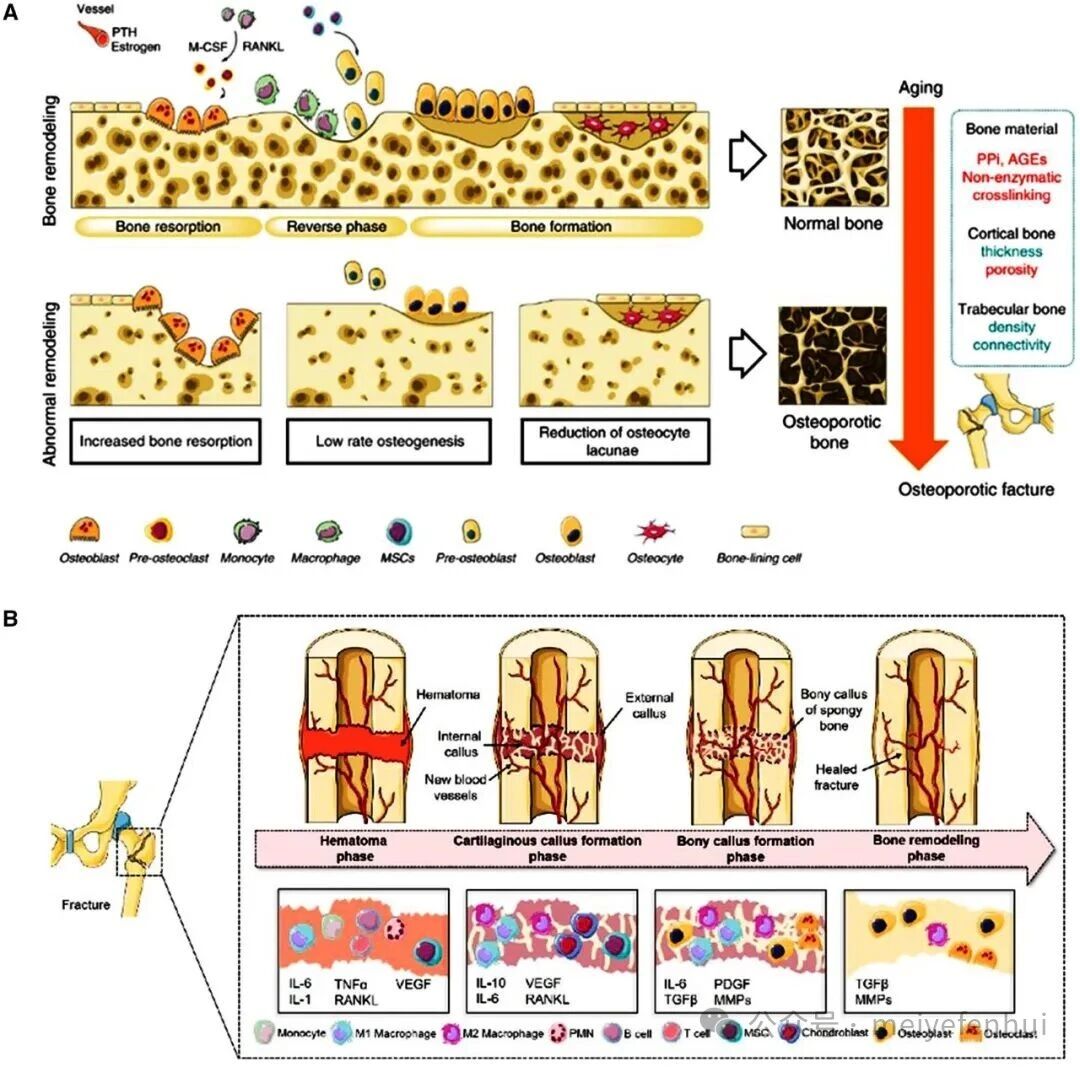
图3 骨质疏松的骨重塑和骨折愈合过程。(A)骨质疏松症中的骨重塑(版权所有©2019,Xie et al.);(B)骨折愈合过程(版权所有©2021,Pfeiffenberger et al.)
2. 钉板固定系统的结构设计原理
骨折的固定原则包括AO(Arbeitsgemeinschaft für Osteosynthese)和BO(生物合成)。相应地,钉板固定系统的结构设计原理可分为三种类型(图4A):
(1)动态压缩螺钉-骨板(DCP)系统
(2)有限接触动态压缩螺钉-骨板(LC-DCP)系统
(3)锁定压缩螺钉-骨板(LCP)系统
与DCP系统相比,LC-DCP系统在骨折愈合方面并无显著优势。基于骨折部位微动可促进骨折愈合并降低延迟愈合和不愈合发生率的证据,开发了LCP系统(图4B和C)。LCP系统能够加速骨折愈合,促进骨痂形成,并提供愈合组织的优越生物力学性能。
临床上常用的LCP系统可根据孔的分布和骨板的特点分为:
(1)传统骨板
(2)非对称骨板
(3)应力分散重建骨板
(4)中央增强骨板
这些骨板在1500 N压缩载荷下的应力分布如图4D所示。为了降低最大应力并使应力均匀分布,可将弹性模量接近骨的镁用于骨板(图4D)。
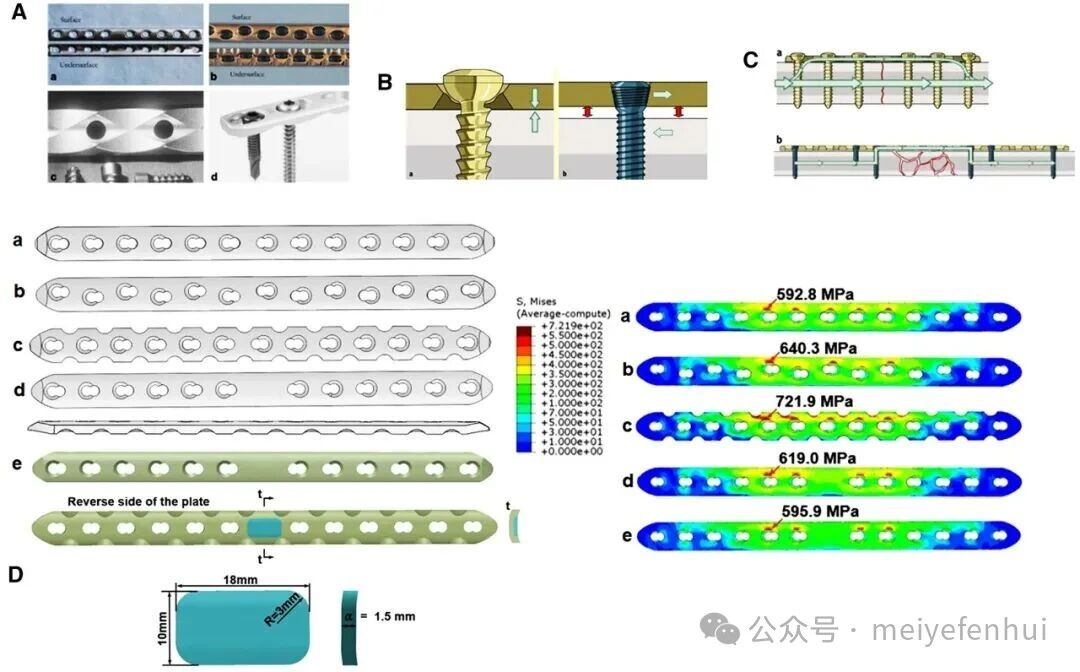
图4 钉板固定系统的设计原理及钉板固定系统的改进,以减少应力遮挡。
(A)钉板固定系统,(a)动态压缩螺钉-骨板(DCP)系统,(b)有限接触动态压缩螺钉-骨板(LC-DCP)系统,
(c)点接触螺钉-骨板系统,(d)锁定压缩螺钉-骨板(LCP)系统(经Elsevier©2007许可,转载);
(B) DCP和LCP固定(经Elsevier©2009许可,转载);
(C)DCP和LCP的力学传递方向(经Elsevier©2009许可,转载);
(D)常见钉板固定系统及其在1500 N压缩载荷下的应力分布,(a)传统骨板,(b)非对称骨板,
(c)应力分散重建骨板,(d)中央增强骨板,(e)改进的骨板(经Elsevier©2024许可,改编)。
3. 钉板固定系统的挑战
LCP系统有潜力显著促进骨折愈合,但钉板固定系统仍面临一些临床挑战:
(1)大多数钉板固定系统主要由不锈钢、钛及其合金组成,除非需要进行二次手术以将其移除,否则它们会留在体内。
这可能会导致不良反应,包括由于螺钉和骨板的磨损、撞击和腐蚀而引起的炎症或过敏反应
(2)如果发生不愈合,承重部位的钉板固定系统在植入后可能会发生疲劳断裂
(3)骨与钉板固定系统之间杨氏模量的不匹配可能会导致应力遮挡
(4)将钉板固定系统应用于复杂骨折(如骨质疏松性骨折和粉碎性骨折)仍然存在较高的延迟愈合或不愈合风险
镁的优点为这些挑战提供了一种潜在的策略。
五、生物降解和生物活性的镁金属的骨科应用
1. 镁离子的生理学功能及其应用前景
镁离子(Mg2+)是超过200种蛋白质的必需辅酶,用于调节人体生理功能。对于直接效应,镁离子缺乏会导致羟基磷灰石晶体增大并降低骨刚度。同时,由于缺乏镁离子,成骨细胞数量减少,破骨细胞数量增加。对于间接效应,甲状旁腺激素的减少会通过减少维生素D的补充来延缓骨形成。毫无疑问,镁也是骨科应用中的有吸引力的材料,因为镁的力学性能与天然骨相似。尽管对镁的毒性存在担忧,即镁离子水平过高可能导致高镁血症,但镁离子在血清中的积累是一个渐进过程,镁的降解过程会将镁离子释放到周围组织中。这些离子随后被代谢,并最终通过肾脏出体外。从基础层面来看,镁基材料释放的镁离子通过镁转运蛋白1(MagT1)和瞬时受体电位阳离子通道亚家族成员7(TRPM7)的介导被运输到背神经元中,从而促进降钙素基因相关肽(CGRP)的释放。随后,CGRP与其受体结合,该受体表达在骨膜干细胞(PSCs)表面,诱导环磷酸腺苷(cAMP)与其反应元件结合蛋白结合。这导致osterix(SP7)的上调,从而有力地刺激成骨,特别是在骨膜区。尽管镁基植入物在肌肉骨骼疾病的外科治疗中显示出潜力,但在临床应用之前,需要进一步的研发来提高镁基骨科器械的耐腐蚀性并降低镁基骨科器械的快速降解的风险。
2. 镁的性能改进
为了提高镁植入物的性能,增加镁的纯度、在镁基体中加入合金元素以及在镁表面涂覆涂层都是潜在的方法,以降低镁基植入物的降解速率。2014年镁合金首次被批准用于骨科植入物,与传统植入物相比,可实现疼痛减半和骨愈合时间减半。镁基螺钉已被报道用于拇外翻、骨软骨炎、远端胫骨、远端腓骨、腕骨、掌骨/骨、近端肱骨、远端股骨和近端胫骨等部位。螺钉具有放射透明性,可以观察骨折愈合的早期过程并减少固定需求。在非负重骨骼部位,镁基螺钉促进骨-植入物界面处的钙化基质形成,并在植入后1年内加速新骨再生以替代植入物的降解。
3. 镁降解产物的生物学功能
镁在骨科中的应用效果归因于其在体内的降解产物,包括Mg2+、氢气和局部碱性环境,这些产物与周围细胞和组织基质相互作用并引发生物学反应。从植入物降解中产生的Mg2+可以渗透到骨基质中,刺激骨膜源性干细胞沿着成骨途径分化并形成新骨。在组织愈合过程中,缺氧是一个短暂现象。镁的降解依赖于氧气,可能维持植入物周围的相对缺氧微环境。酸性微环境的存在与动物模型中骨结构破坏和骨坏死的高发生率相关,而碱性微环境显示出对骨坏死的潜在保护作用。H2可以作为一种有效的抗氧化干预措施,保护细胞免受氧化损伤。镁支架降解诱导pH升高、Mg2+浓度增加和渗透压升高,可以实现抗菌。
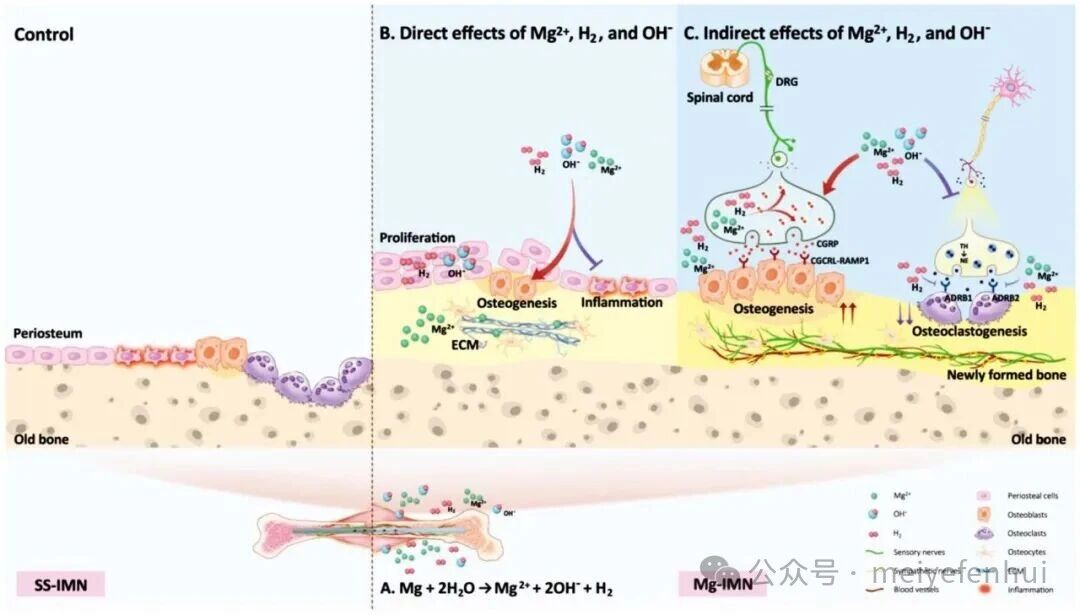
图5 镁的降解产物调控骨质疏松性骨折愈合。(A)镁的降解产物;(B)Mg2+、H2和OH-的直接影响;(C)Mg2+、H2和OH-的间接影响(版权所有©2025,An et al.)
4. 镁在非负重部位治疗SAON的实践
由于骨髓脂肪的破坏和脂肪栓塞的形成,随之力学调控和化学调控失稳形成血栓,导致骨坏死。骨坏死的特征是骨髓脂肪组织和造血细胞的坏死,骨小梁内的空骨细胞和空骨细胞陷窝。一种创新的高纯度镁螺钉被用于固定从髂骨获取的骨瓣以修复坏死的股骨头。随着镁的降解,镁螺钉的直径在术后12个月大约减少了25%,改善了人体股骨头的血供。
5. 镁基生物材料在骨科应用中的挑战
与传统惰性材料相比,可降解金属的研究仍处于起步阶段,为创新提供了广阔的机会。镁基植入物需要在受伤组织的愈合过程中保持机械稳定性。镁基植入物的应力腐蚀受到周围环境和镁基植入物几何设计的影响。可利用有限元分析计算优化螺钉的结构,以减缓镁基植入物的应力腐蚀(图6)。
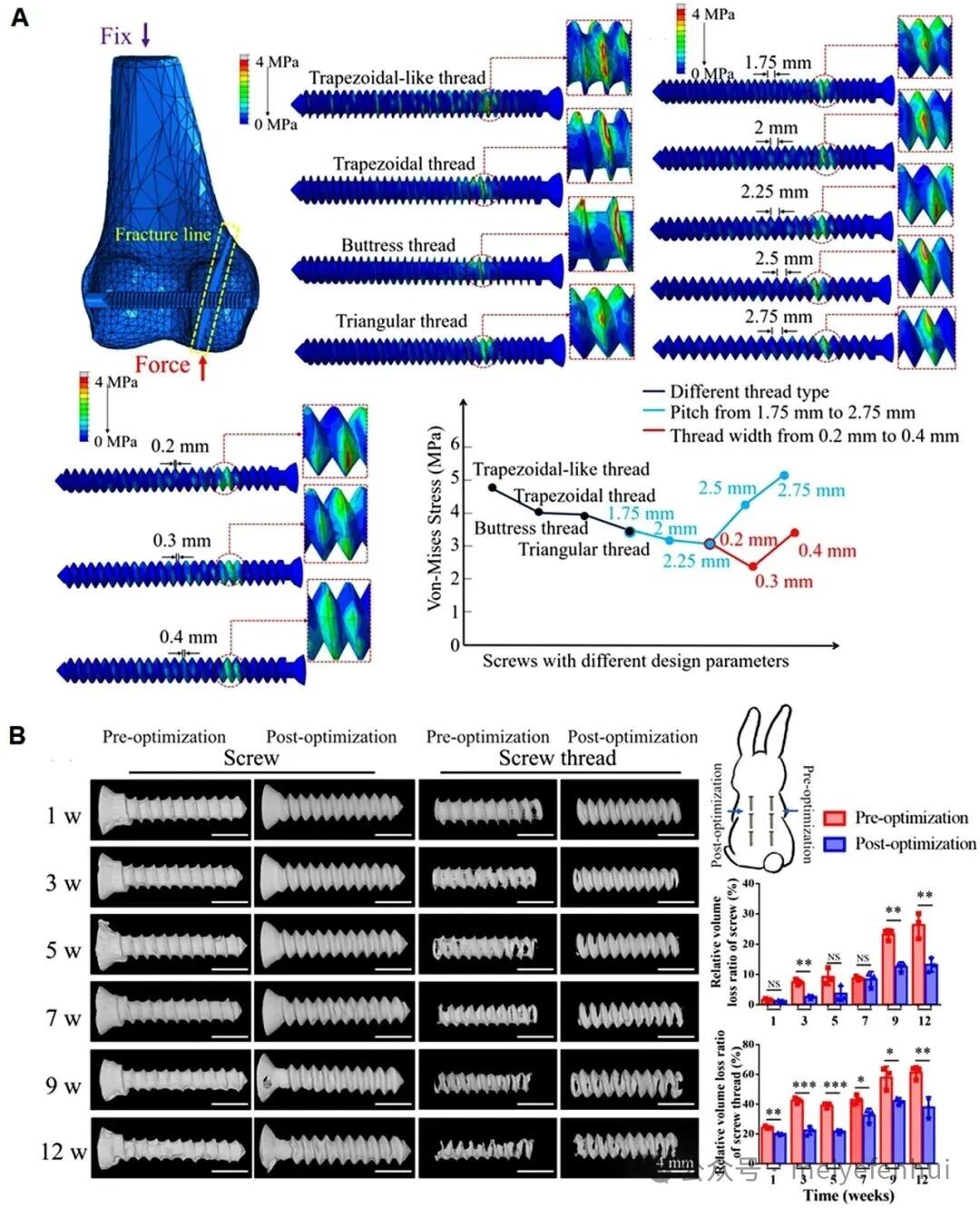
图6 根据应力分布对界面螺钉的结构进行优化,以降低材料的降解速率。(A)不同特征的镁螺钉的应力分布;
(B)优化前后不同时间镁螺钉在兔背部皮下组织内的三维形态及损失率统计。
NS:无统计学意义,*P<0.05, **P<0.01, ***P<0.001(经Elsevier©2024许可,转载)
六、用于骨折固定和增强愈合的骨科组合植入物的研发
1. 骨科组合植入物的概念
骨质疏松性骨折的骨质量下降和愈合能力受损对骨科医生来说是一个巨大的挑战。许多包括生物活性镁植入物与传统非可降解钛内固定的镁/钛组合固定系统已被开发出来,以应对骨质疏松性骨折固定的挑战。镁/钛组合固定系统的设计确保了钛植入物提供足够的机械强度,而镁植入物则促进骨折愈合。鉴于镁的杨氏模量和屈服强度与人皮质骨相当,将其纳入固定系统可以减少传统植入的刚度。尽管镁和钛之间由于电极电位差异(镁:-2.356 V,钛:-0.163 V)产生电偶腐蚀导致镁的快速降解。实际上,我们之前的研究中使用的镁/钛组合固定系统的动物模型显示,镁的降解速度更快,有利于早期加速骨折愈合。因此我们镁/钛组合固定系统的概念是利用镁的生物降解促进成骨的功能,而非其机械性能,其中镁部件不提供骨折固定功能,这种组合固定系统进一步应用于临床试验仍需证据的支持。
2. 组合骨科植入物的临床转化过程
创新的镁/钛组合固定系统的开发遵循一个系统的研发流程,如图7所示。它从研究阶段开始识别骨科应用中遇到的临床挑战和具体问题。设计阶段侧重于组合固定系统的优化和开发。同样重要的是,在这一阶段申请专利,以保护知识产权,并为技术转让或临床转化做准备。产品阶段主要是推出市场的准备。这包括进行临床试验,以验证创新组合固定系统在体内应用的整体性能。产品在其整个生命周期中必须符合相关标准、法规和法律。一般来说,这种系统化的方法有助于将镁/钛组合固定系统从概念有效地转化为临床应用,增强骨折固定和促进骨愈合以及避免翻修手术。
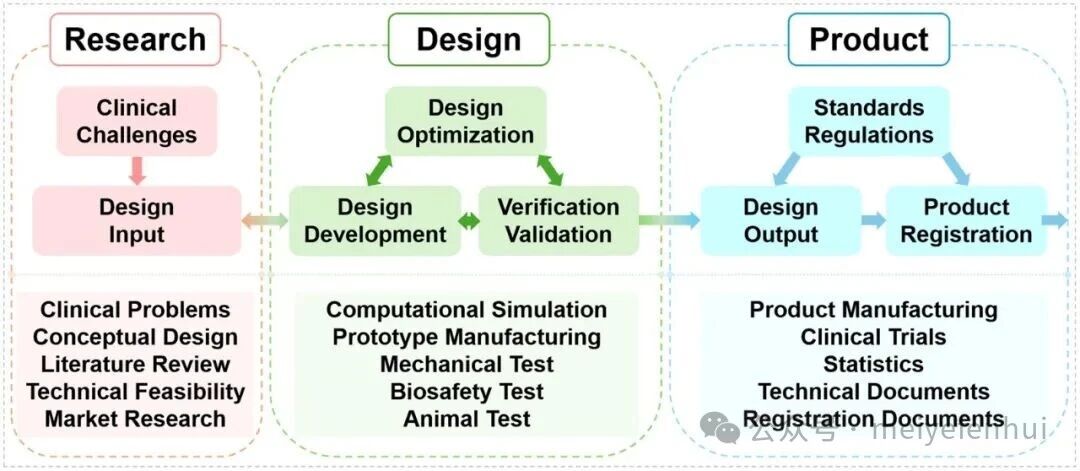
图7 创新型镁钛组合固定系统的研发流程。
七、总结与展望
可降解镁在骨科中的应用仍处于初级阶段,然而,随着材料科学家、工程师和临床科学家以及监管机构之间合作的加强,可降解镁植入物的快速增长将在不久的将来实现。本综述系统地分析了镁在骨科应用中的前景和基础研究,并提出了基于临床需求的镁在非负重部位和负重部位的骨科应用方案。为满足在非负重部位治疗SAON的临床需求,镁螺钉和基于镁的复合多孔支架(Mg/PLGA/TCP)已被开发。利用镁降解的良好生物学效应并克服骨折固定中机械稳定性的弱点,本文提出了开发镁/钛组合骨科植入物的概念。最后,阐述了镁基医疗器械的转化过程,以促进其作为创新骨科植入物的临床转化。本综述有望为新型生物材料转化提供参考框架,并将促进创新骨科生物材料的临床应用发展。
课题组简介
通讯作者
秦岭,香港中文大学教授、博士生导师。欧洲科学院院士,美国医学与生物工程院院士,病理学与病理生理学专家、骨科专家,香港中文大学医学院助理院长(内地事务)、卓敏矫形外科与创伤学教授,香港中文大学深港创新研究院(福田)院长,香港中文大学医学院骨关节肌肉研究实验室主任,2009年创建并任中国科学院深圳先进技术研究院医工所转化医学研究与发展中心主任。长期致力于骨科疾病的基础研究、应用研究和转化研究,是研发镁基金属骨科植入材料的著名专家,系统深入地研究了镁基植入物促进骨再生的生物学机制,系列成果发表在Nature Medicine等权威杂志,部分内容被纳入ISO 安全性评定新标准,成功开展多项多中心临床试验,领衔推动了国内第一款含镁骨科内植物的临床转化并获得NMPA的批准上市。近年来承担十三五国家重点研发计划项目、国家科技重大专项、科技部国际合作项目及香港RGC、HMRF、ITF等30多个项目,发表了包括Nature Medicine,Materials Today,Journal of Clinical investigat等在内的数百篇SCI论文,引用35000+次。已获数十项国内/国际专利授权,参与制定多项行业标准,荣获30余项科技奖项;作为主编创办Journal of Orthopaedic Translation(中科院和JCR双一区),主编《骨内科学》、《可降解金属》等多部专著。
黄文扬(Ronald Man Yeung Wong)香港中文大学临床副教授、博士生导师。主要研究方向为脆性骨折、骨质疏松症和肌肉减少症。目前为骨合成和创伤护理基金会(OTCF)当选主席和亚洲动态骨合成协会(AADO)主席。在Journal of Cachexia,Sarcopenia and Muscle,Aging Cell,Acta Biomaterialia等期刊发表论文80多篇,曾多次受邀在会议上发表演讲,并获得多项创新研究项目的资助,包括合作研究基金、研究影响基金、普通研究基金、健康与医学研究基金、创新与科技基金和骨合成与创伤护理基金。亦获香港医学专科学院颁授杰出青年院士称号。
原文信息
Ningze Zhang, Qida Zhang, Hongwei Shao, Zhengming Shan, Jiankun Xu, Wenxue Tong, Ronald Man Yeung Wong*, Ling Qin*, Magnesium as an emerging bioactive material for orthopedic applications: bedside needs lead the way from innovation to clinical translation, Regenerative Biomaterials, Volume 12, 2025, rbaf032, https://doi.org/10.1093/rb/rbaf032










