导 读
关键科学问题:可降解镁合金在骨科应用中常面临强度不足与腐蚀过快的两难,且传统Mg-RE(稀土)体系如WE43依赖较高REE含量引发生物安全顾虑。如何在降低稀土总量的前提下,通过微结构精准调控实现力学-耐蚀-成骨的一体化优化,是长期未解的瓶颈。
2025年11月04日,北京大学等联合团队在Bioactive Materials在线发表题为“低含量Er与Zn掺杂的医用镁合金在骨科应用中的综合性能提升:体内外研究”的研究论文,系统设计Mg-(1,3)Er-(1,3)Zn合金并筛选出Mg‑1Er‑1Zn,证明其在体外(浸泡/电化学/细胞)与大鼠体内(Micro‑CT/组织学/血液学/元素分布)均表现出均匀可控降解、较高强度与优良成骨性。

总之,研究提出“低剂量稀土+协同微结构调控”策略:Er用于晶粒细化,Zn促进动态再结晶并调控第二相(W相)弥散分布,实现力学与耐蚀的平衡;其中Mg‑1Er‑1Zn在6个月植入后仍具结构完整性,体内降解速率约0.27 mm·y⁻¹,显示出明确的骨科应用潜力,为可降解Mg‑RE‑Zn医用合金的“减稀土化”提供了可行范式。(数据与结论依据原文)
👩⚕️ AI快评 • 最大亮点:在≤3 wt%低剂量稀土框架下,通过Er细化+Zn促再结晶实现强度—耐蚀—成骨的三重统筹,优选出Mg‑1Er‑1Zn这一平衡点。 • 贡献:为“高REE含量—生物安全”悖论提供减量化替代,并以完整的体外/体内证据链验证长期骨整合与系统安全。 • 潜在价值:有望用于骨科螺钉/微型板等高强度需求场景;与表面涂层/LPSO相调控/AI材料设计结合,可进一步定制降解曲线。
摘 要
稀土元素(REEs)作为镁(Mg)的常用合金化元素,因其在熔体净化与力学强化方面的突出作用而被广泛研究。然而在骨科应用中,迄今获得CE认证的Mg‑RE植入物仅源自WE43合金,该合金含有较高比例的稀土(4 wt% Y与3 wt%混合稀土),引发生物安全方面的担忧。未来的Mg‑RE合金应在降低稀土用量与种类的前提下实现性能提升。本研究在Mg中加入低含量Er与Zn(≤3 wt%)。结果表明:Er促进晶粒细化,Zn促进合金的动态再结晶;与二元Mg‑Er或Mg‑Zn合金相比,Er/Zn协同可进一步强化合金。在所研究的系列中,Mg‑1Er‑1Zn表现出突出的综合性能,具有相对均匀的腐蚀形貌、优良的力学指标与显著的成骨特性,显示出骨科应用潜力。基于上述结果,建议在开发新型Mg‑RE‑Zn骨科植入材料时,采用优化的微结构调控并严格控制稀土种类与加入量,作为实现综合性能提升的关键策略。
研究方法
总体思路:设计Mg-(1,3)Er-(1,3)Zn系列,通过熔炼—热挤压成形,开展微结构/力学/腐蚀/电化学/细胞/血液相容性/大鼠体内骨整合与系统安全的分层评估,筛选力学—降解—生物学性能最优配比。
• 样本/模型:Mg-(1,3)Er-(1,3)Zn、Mg-(1,3)Er、Mg-(1,3)Zn合金棒材(直径约12 mm),体外:Hank’s溶液浸泡与电化学;细胞毒性与溶血;体内:大鼠骨内植入模型(Micro‑CT、组织学、血液学、器官元素分布)。(见文献2.7节)
• 关键材料/工具:真空感应熔炼(VIM)/Ta坩埚;热挤压(挤压比≈10);光学显微镜、SEM/EDS、XRD;拉伸/显微硬度;电化学(OCP、极化曲线、icorr)。
• 实验流程要点:成分限定≤3 wt%(Er、Zn);表征晶粒与第二相(W相,Mg3Er2Zn3);240 h浸泡计权损;10 d pH演化;细胞提取液法评估(ISO 10993‑5);溶血率(ISO 10993‑4);随访至6个月评估骨整合与体内降解。
• 统计分析:见原文2.8节;图中显著性与统计方法以论文为准。
• 重复性与可用性:多批次成分/结构/性能交叉验证;体内外一致性讨论并与临床CE标产品对标(如Magnezix®)。
图表展示

图1. 挤压态合金的光学显微与SEM微观组织及XRD相组成:比较Mg‑Er‑Zn、Mg‑Er、Mg‑Zn的晶粒与第二相;三元合金检测到W相(Mg3Er2Zn3),其峰强度随Er/Zn含量升高而增强。
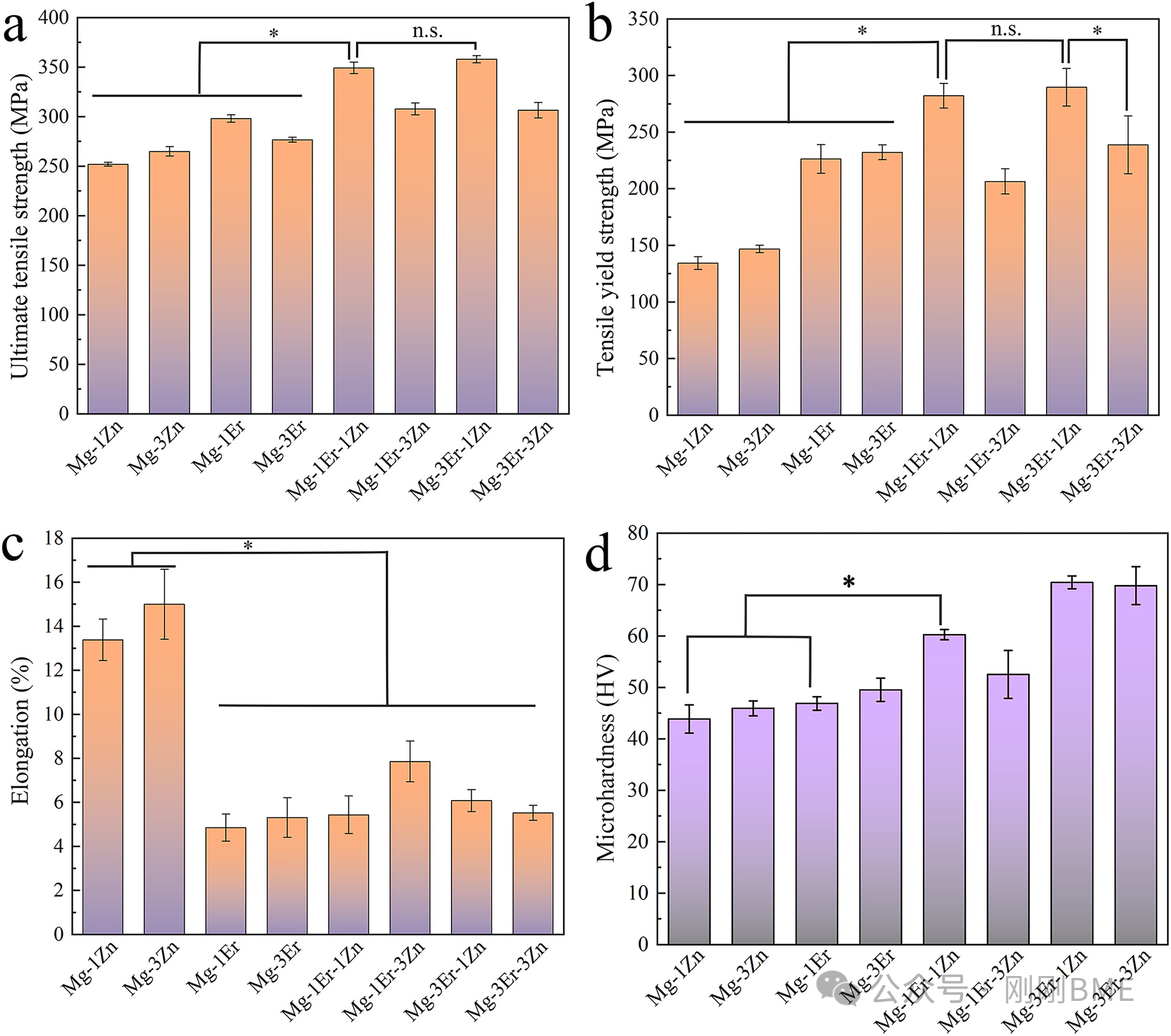
图2. 力学性能(UTS、TYS、杨氏模量、延伸率、显微硬度):Mg‑1Er‑1Zn与Mg‑3Er‑1Zn的TYS约282±11与289±17 MPa;三元3–3配比因W相过量导致强韧性下降。
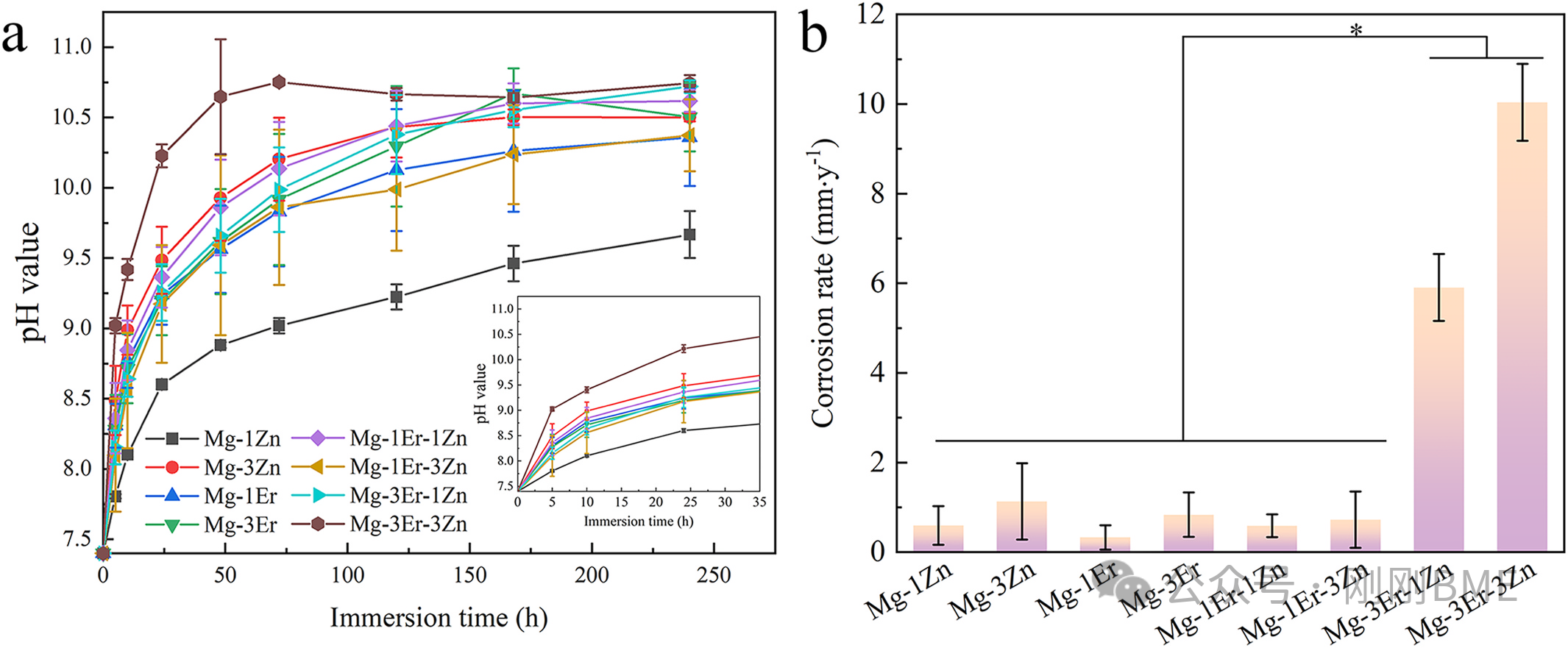
图3. 10天浸泡的演化与240 h质量损失计算的体外腐蚀速率:3Er‑3Zn腐蚀加剧;Mg‑1Er‑1Zn呈相对均匀腐蚀与中低速率。

图4. 120 h浸泡后的截面形貌与EDS元素映射:Mg‑1Er与Mg‑1Er‑3Zn呈双层腐蚀膜(内层Mg/O,外层Ca/P/O),而Mg‑1Er‑1Zn腐蚀层更薄且均匀,少见深孔蚀。
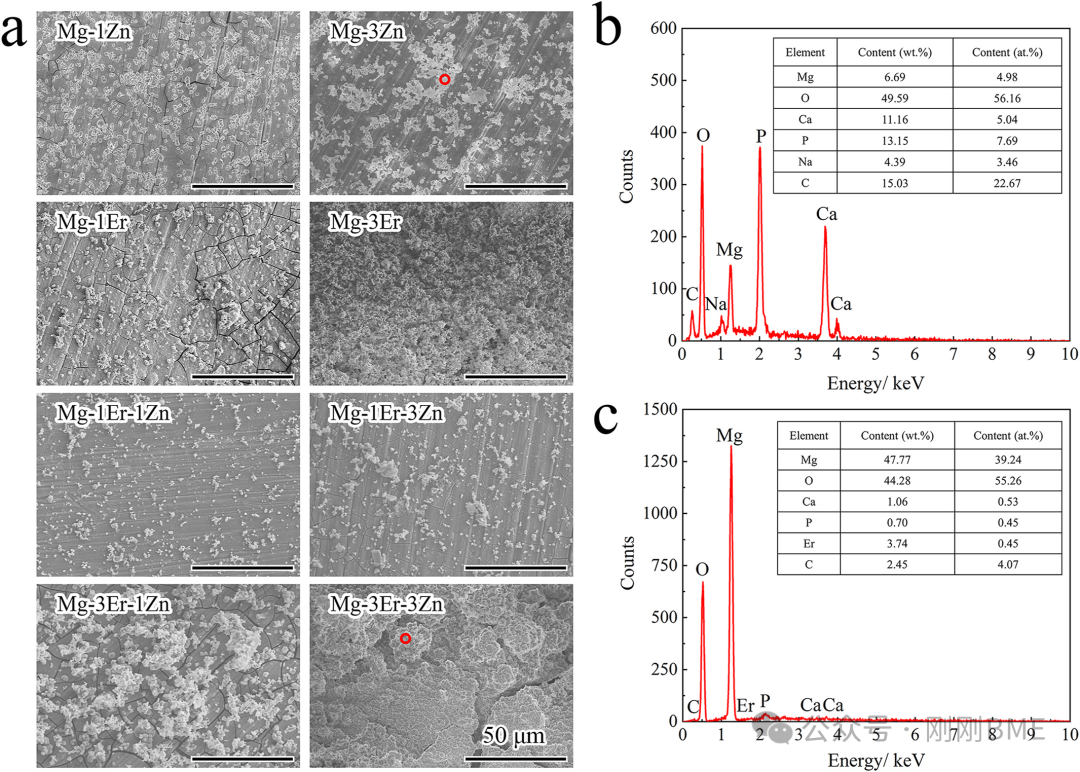
图5. 240 h浸泡后的表面形貌与XRD腐蚀产物:3Er‑3Zn样品更致密但表明更重腐蚀;腐蚀产物Ca/P比例降低,与EDS一致。
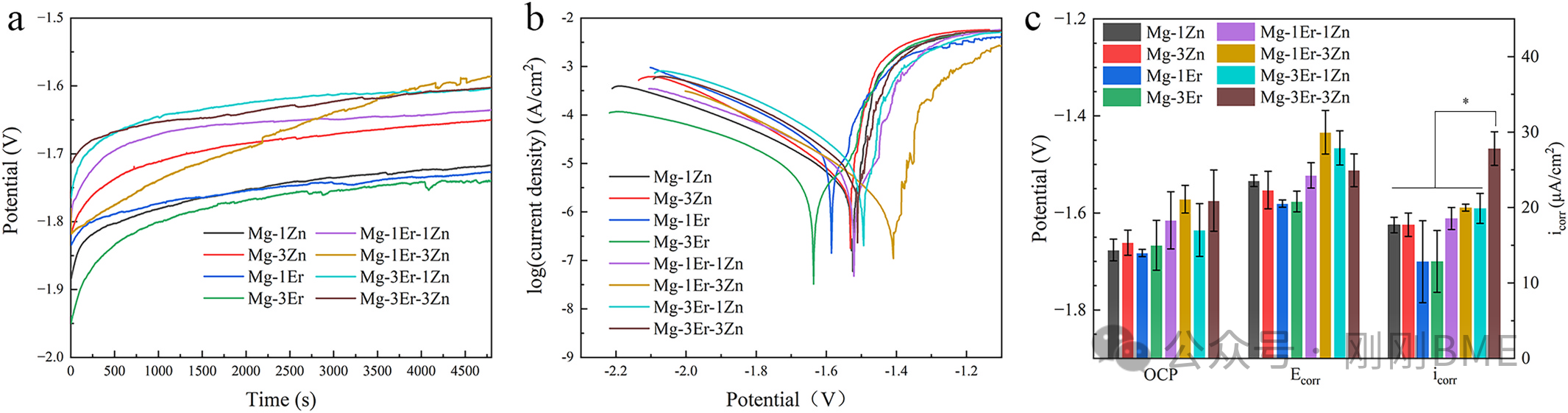
图6. 电化学评估(OCP、极化、icorr):3Er‑3Zn的腐蚀电流密度28±2 μA·cm⁻²最高;OCP波动与腐蚀膜形成/溶解相关。
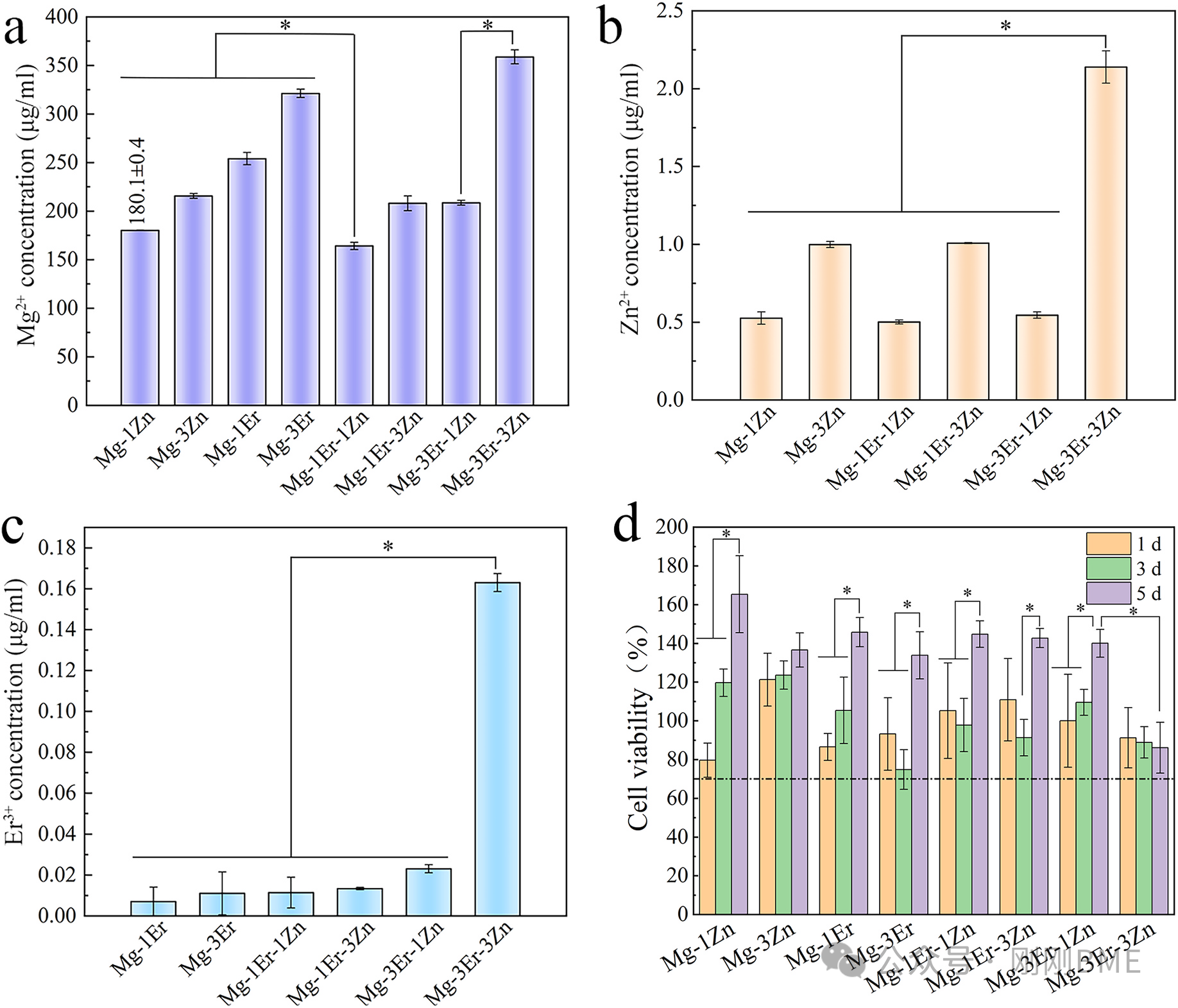
图7. 提取液离子释放(Mg²⁺/Er³⁺/Zn²⁺)与细胞活力:1Zn与1Er‑1Zn离子释放最低;所有组5天活力>70%(ISO 10993‑5判定为无细胞毒)。
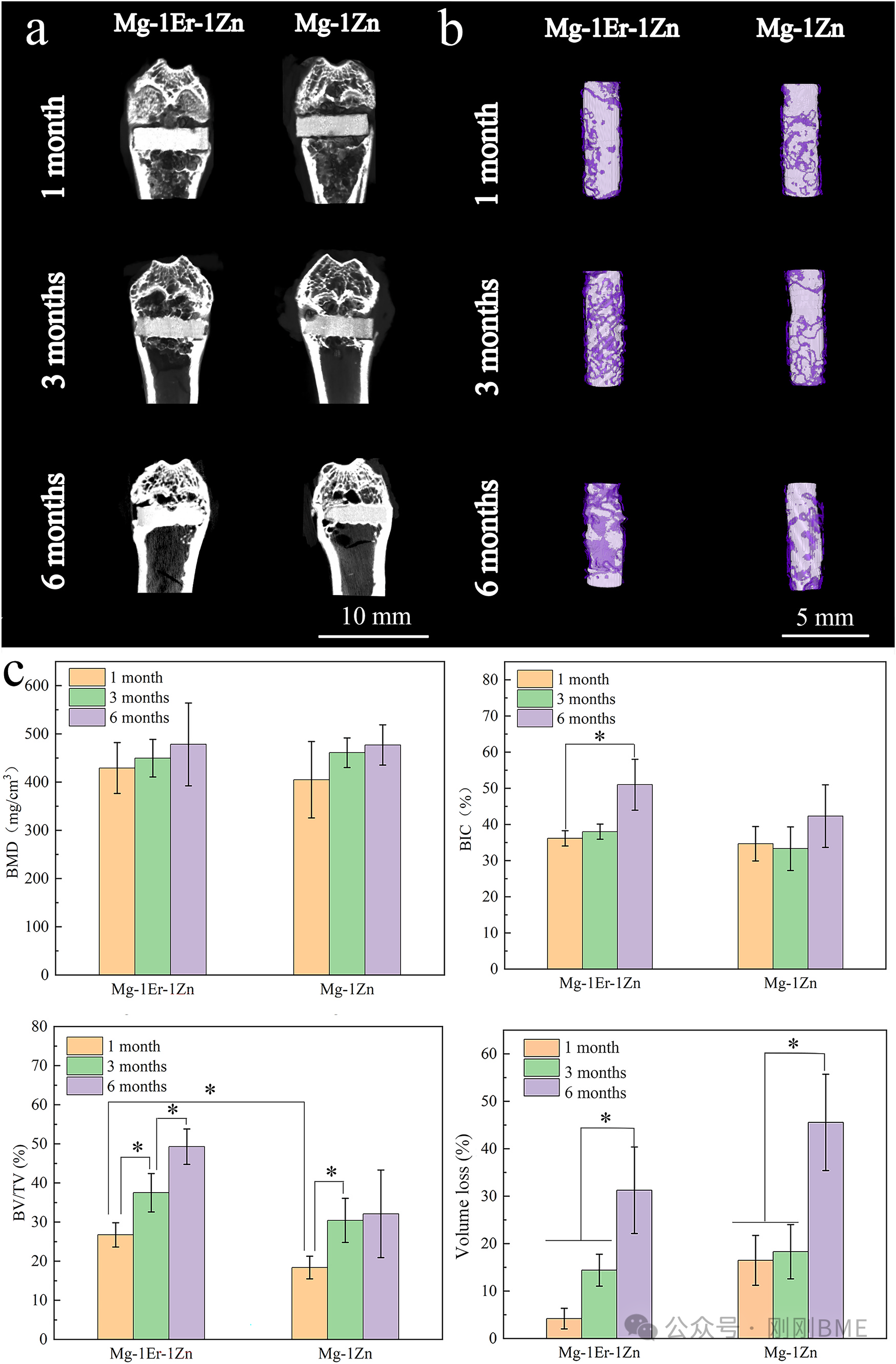
图8. 体内Micro‑CT三维重建与指标(BMD、BIC、BV/TV)及体积损失:Mg‑1Er‑1Zn显示更优骨整合与较低体积损失(6个月约31±9%)。
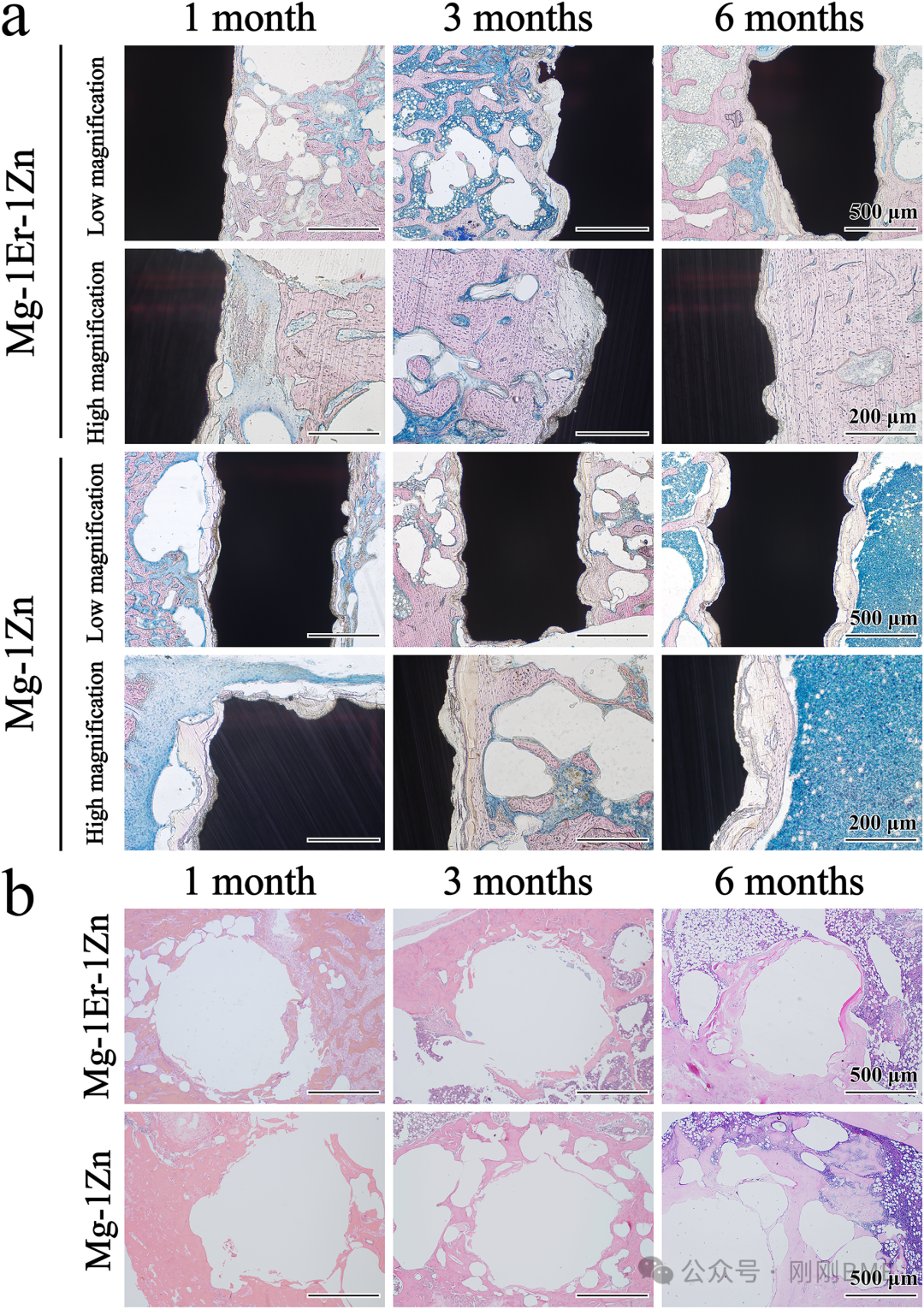
图9. 硬组织切片MB/AF与去钙骨H&E:不同时间点(1、3、6个月)显示新骨生成与界面愈合进程。
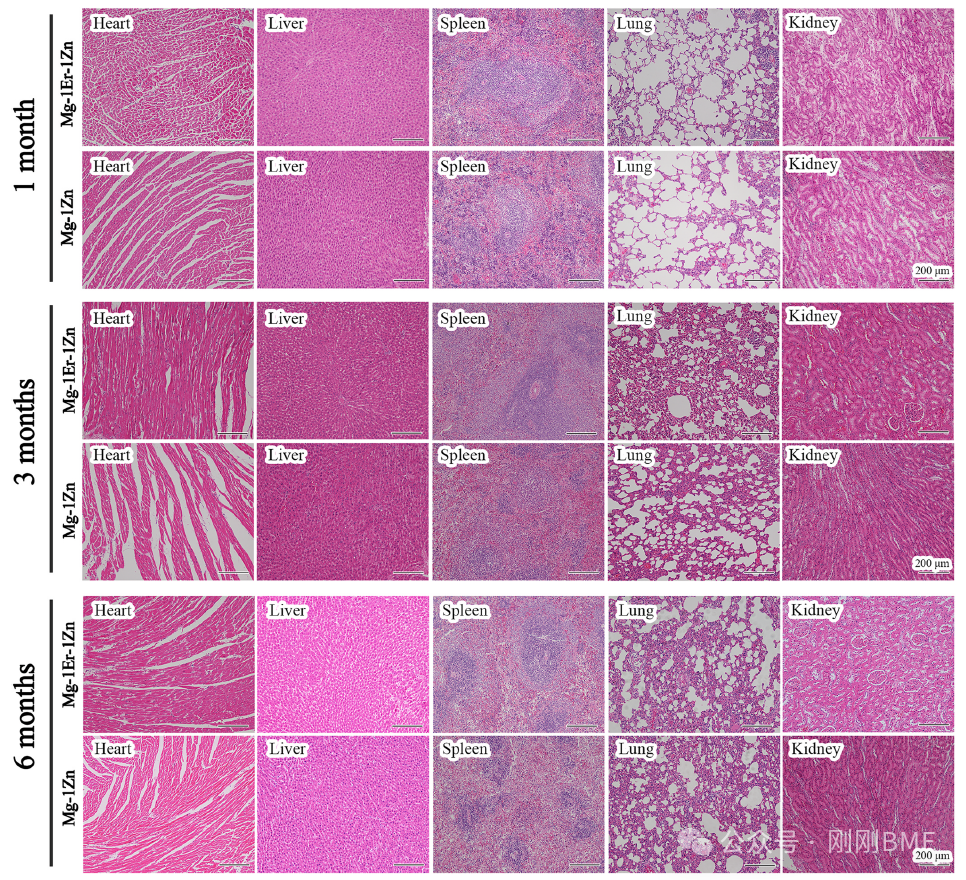
图10. 主要脏器H&E(心/肝/脾/肺/肾):多时点组织学未见异常。

图11. 植入6个月后的骨—植入体界面截面形貌与元素映射:新骨(B)、植入体(I)、腐蚀产物(CP)可辨;离子聚集未见连续性沉积。
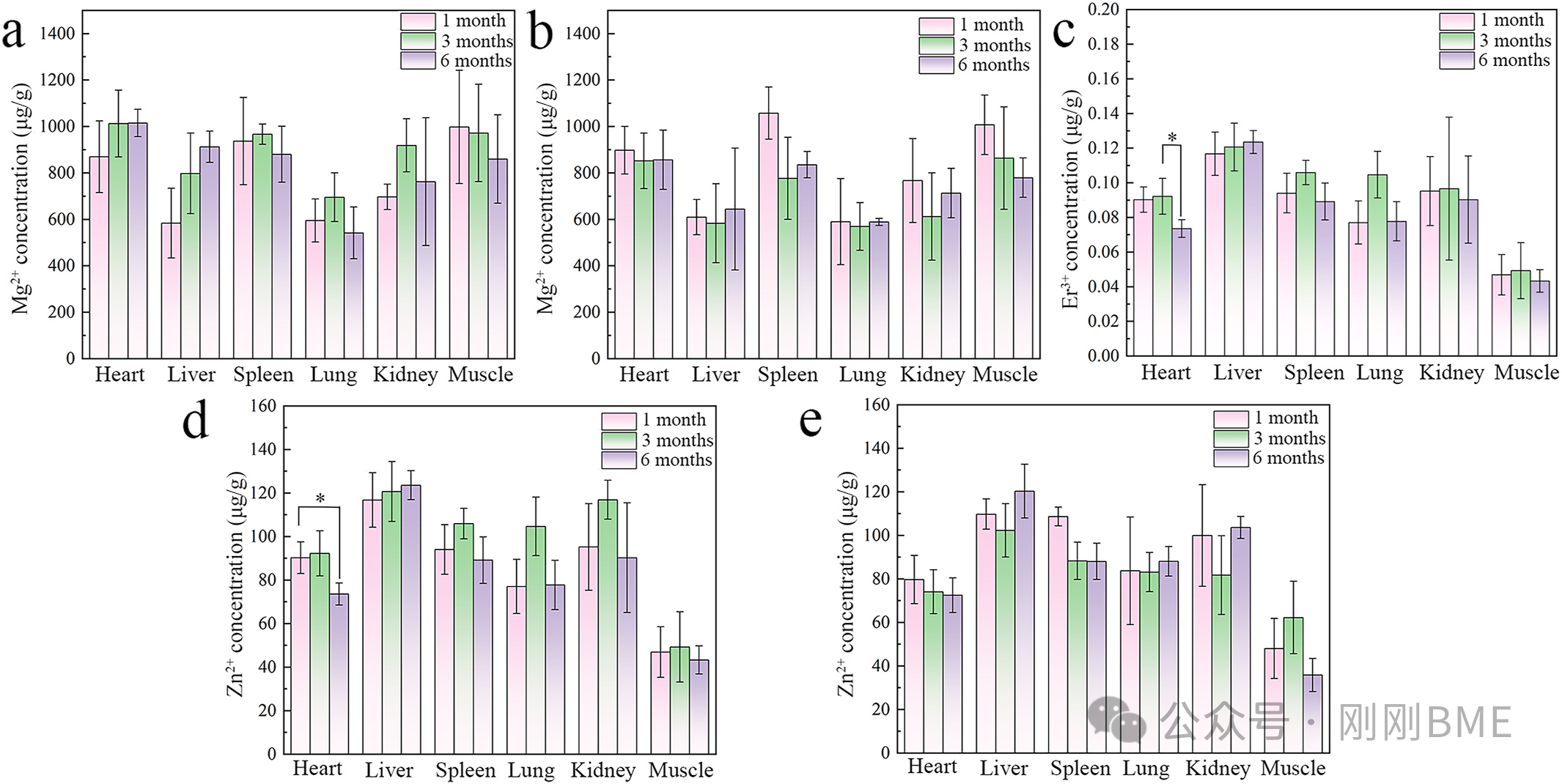
图12. 体内Mg²⁺/Er³⁺/Zn²⁺在组织与器官中的浓度:各器官水平低且无持续累积;Mg²⁺维持稳态。
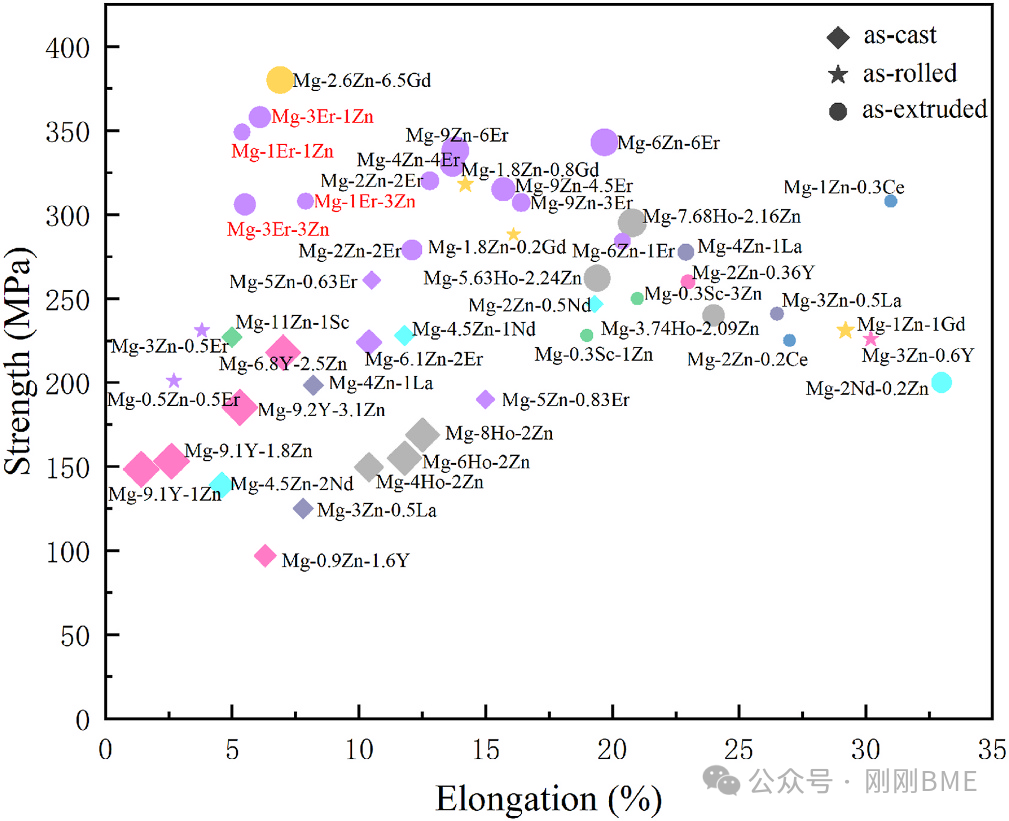
图13. 文献对比的Mg‑RE‑Zn合金力学性能综述:在REEs≤10 wt%范围内,Mg‑1Er‑1Zn以更低稀土含量实现更高强度。
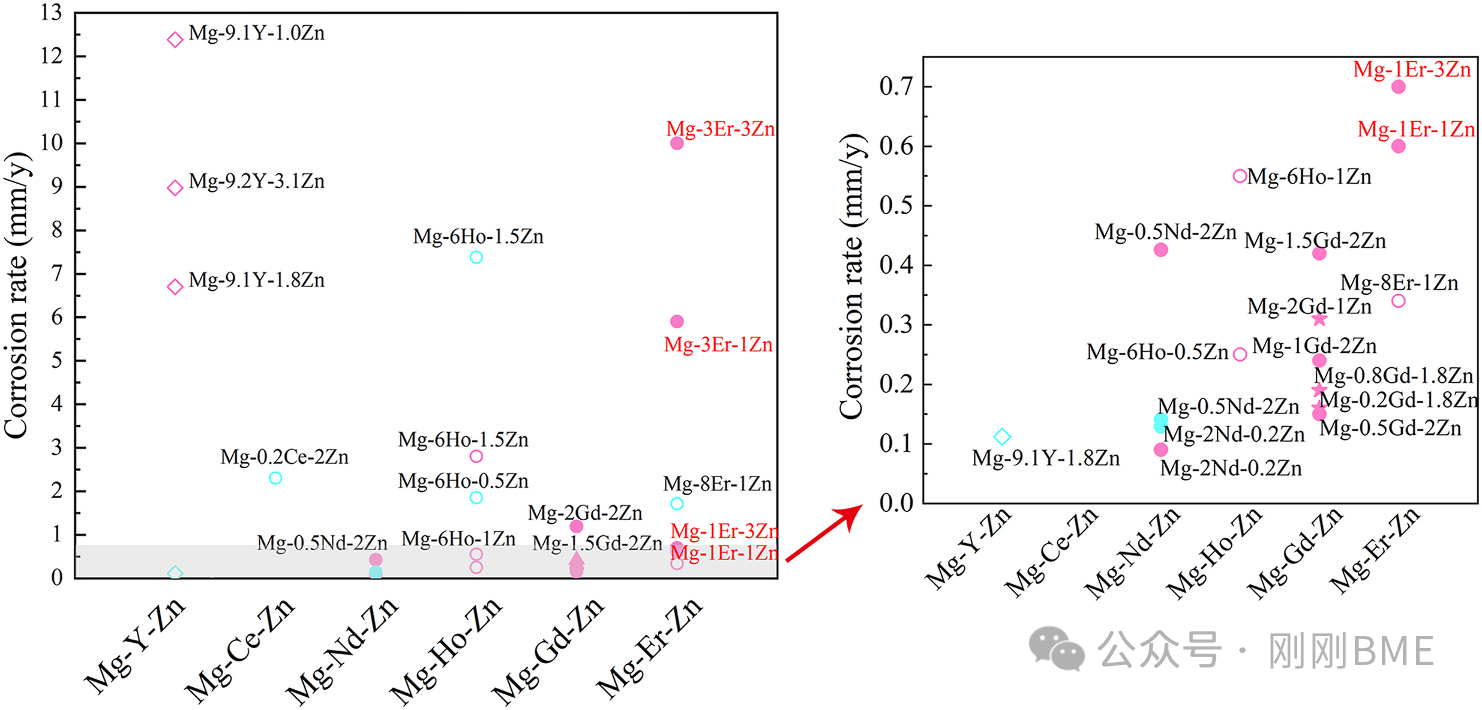
图14. 文献对比的体外腐蚀速率:标注加工态与介质类别;本研究的Mg‑1Er‑1Zn处于较低区间。










